今日は酸・塩基平衡について書いていこうと思います。この分野って難しいですよね。先生たちも(少なくともうちの大学だと)、Henderson-Hasselbalchとかいう式で一元的に説明しようとして、余計にわけわからなくなる感じでした。
この分野で大切なのは、①肺と腎臓が司ること、②基本的にpHとCO2、HCO3で評価すること、③酸と塩基が綱引きしてるイメージを持つことの3点かなと思います。
まず、pHに目を向けましょう。正常では、7.4±0.5です。これより低ければアシデミア、高ければアルカレミアです。細かい話ですが、アシドーシス、アルカローシスは、pHを上下させる因子や病態をいい、それぞれが単独で存在する場合、アシドーシスでアシデミアに、アルカローシスでアルカレミアになりますが、アシドーシスとアルカローシスが同時に存在する場合は、より勢いのある方へ傾いていきます。
次に呼吸性か代謝性かの鑑別です。アシドーシスとアルカローシスはそれぞれ、CO2の変化がきっかけとなる「呼吸性」、HCO3の変化がきっかけとなる「代謝性」に分類されます。例えば、アシデミアの状態で、CO2濃度の上昇を伴っていれば、呼吸性アシドーシスとなります。ただ、忘れてはいけないことは、生物には恒常性(ホメオスタシス)が伴っていることです。すなわち、代償性変化をともなうため、アシドーシスもしくはアルカローシス単体で存在することはないということです。そこが考えにくい点なのかなと思っています。でも、慣れると意外とすんなりわかると思います。
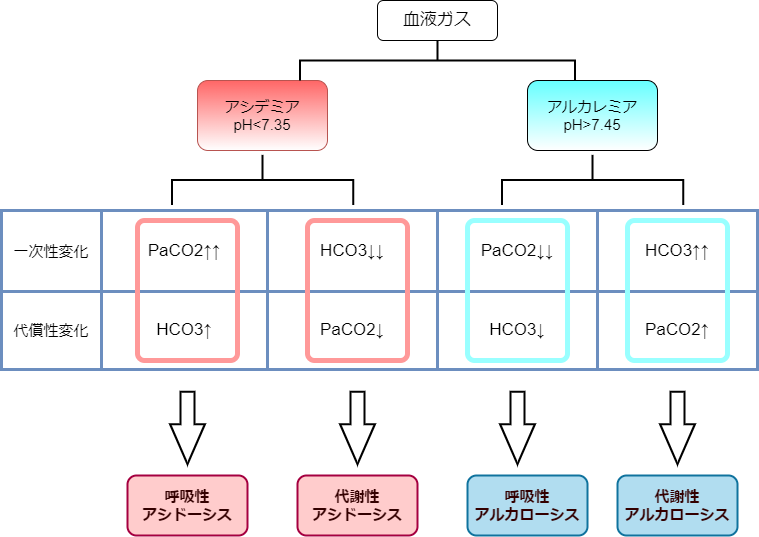
それから、病態をもとに推測にできるようになると、より理解が深まるかもしれません。例えば、COPDや重度の喘息といった呼吸不全のある患者さんがいたとします。この場合、呼吸ができないということは、肺から二酸化炭素が排出できない、つまり、酸が体内に蓄積している状態です。となると、呼吸性アシドーシスが一次性変化として生じてそうだな、みないな感じです。
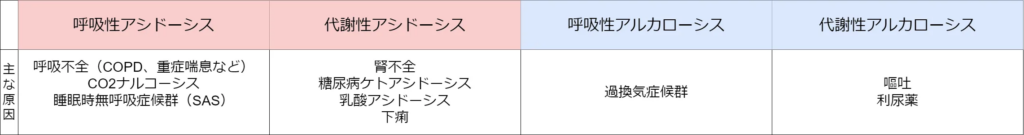
ここまで、大丈夫でしょうか。最後に、代謝性アシドーシスが生じている場合、AG(アニオンギャップ)を計算しましょう。ここで、AGについての解説をします。
そもそも、AG(アニオンギャップ)は次の式で与えられます。
AG=[Na]ー[Cl]ー[HCO3]。
ここで、体液中の陽イオンと陰イオンの濃度は電気的中性を保つために等しいです。その際、通常の検査では、測定されない陽イオン(Na以外の陽イオン)をUC、陰イオン(Cl、HCO3以外の陰イオン)をUAとします。すると、次の式が成り立つはずです。
[Na]+UC=[Cl]+[HCO3]+UA。これを変形すると、[Na]ー [Cl]ー[HCO3]=UAーUC となります。この左辺ってAGですよね。すなわち、AGを計算することでUAの増加の有無を推定することができます。
代謝性アシドーシスになる原因って、HCO3が喪失されるか、UAっていうよく分からない酸が増えるかの2つに大別されます。高AG性代謝性アシドーシスだなんだって賢い人たちは分かるかもですけど、よく分かんない酸(乳酸だったりケト酸だったり)のせいで代謝性アシドーシスになってたらAG上昇って考えれたら、それでいいのかなと思います。
今回はここまでにしようかなと思います。補正した値とか、本当はもっと色々考えないとですけど、筆者もまだまだ勉強不足なのですいません。最後に、自分の大学では、臨床の講義が1か月で2科目を同時並行で進めるみたいな感じなんですけど、呼吸器と腎・泌尿器がセットの月があって、こういう意味合いなのかなって感じました。